近期,博腾生物Dr. Damien Marsic针对AAV的改造筛选取得了重要的科研成果,文章“Engineering and in vitro ion of a novel AAV3B variant with high hepatocyte tropism and reduced seroreactivity”发布于Molecular Therapy。

基因治疗的载体有病毒载体和非病毒载体两类,腺相关病毒(Adeno-associated virus,AAV)是研究最活跃的基因治疗病毒载体之一.
AAV病毒属于细小病毒家族,无包膜,仅由衣壳蛋白和核酸组成,外形由二十面体组成,内部核酸基因约4.7kb,自己不具备复制包装的能力,需要辅助病毒基因存在才能进行包装。目前发现的天然AAV血清型有13种,分别命名为AAV1-13。不同血清型的病毒衣壳蛋白存在差异,衣壳初步决定了病毒和宿主之间的相互作用,这在一定程度上赋予了AAV趋向细胞或者组织的类型,这也可以用来限制AAV转导到特定的组织和细胞。
表1主要血清型的结合受体
|
|---|
野生型的AAV存在一些局限性,对于很多组织并非都具有很高的转导效率,影响其转导效率的原因主要有:一,组织细胞膜表面的受体和病毒衣壳表面的配体结合效率低,使病毒颗粒不能顺利进入细胞;二,病毒进入组织细胞后被胞内的酪氨酸激酶识别,接着被磷酸化,使其失去自身的转染能力;另外,机体内预先存在的一些抗体也会影响AAV在细胞内的表达。常用的提高转导效率的方法是对AAV进行工程化改造,改造后的变种以及靶向能力可能会得到增强。工程化的方法包括DNA重组,插入突变,随机肽插入,衣壳文库构建等。衣壳经过改造后,改变了野生型AAV的趋向性,并且对一些转导不敏感的细胞也有明显的侵染性,体内和体外均能够高效的转导靶细胞,如:人气管上皮细胞、神经干细胞、多能干细胞、视网膜细胞等。
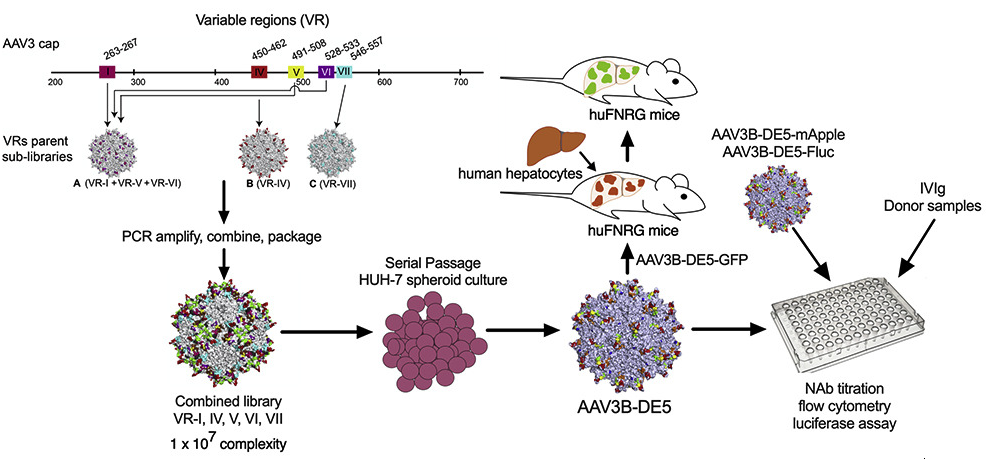
在本篇关于工程化AAV的研究型文章中,主要是针对AAV3进行改造筛选。rAAV3是新兴的一种作为定向肝脏表达的候选血清型,文章通过从AAV3B的衣壳中直接进行进化,通过构建衣壳中可变区域的文库在体外选择能够靶向肝脏的AAV突变体。仅对AAV3B衣壳表面的可变区(Variable Regions,VRs)进行修饰,以保持其结构的完整能够组装成为完整有效的病毒颗粒。通过建立衣壳文库得到含有大量衣壳突变序列,在体外对HUH-7形成的人源肝类器官进行体外转染试验,经过对所构建的文库进行一系列的筛选,最终得到一个AAV3B定向进化的序列AAV3B-DE5。
在人源肝嵌合huFNRG小鼠模型的结果表明AAV3B-DE5对人源化小鼠的肝脏具有更高的侵染力。 通过在100名健康捐献者的血清样本试验后发现,AAV3B-DE5能够降低人源IVIg的血清反应。因此,利用文库组合的方式,能够筛选产生一个新的病毒衣壳,该衣壳对人源的肝脏具有很强的趋向性,并且能够规避血清中已经存在的AAV抗体。




